En genfortælling om meget mere end basedannende kost og gigt.
Af Ken Lunn MSc. (Herb. Med.)
MNIMH (GB)
Introduktion
Vores fysiologi har igennem evolutionen udviklet sig til at kunne håndtere mange forskellige typer madvarer, og derved er kroppen blevet udrustet med evnen til at kunne håndtere indflydelsen af en varieret kost på syre-basebalancen. Det er netop denne evne, som bliver udfordret i vores moderne kultur, når kosten bliver ensformig, eller hvor der følges en bestemt kostplan, der indskrænker tilgangen til et bredt næringsgrundlag.
Syre-basebalancen har været et omdrejningspunkt for mange behandleres tilgang til en sygdomsforståelse, hvor både kost og livsstil sættes i fokus. Der er skrevet mange bøger om emnet gennem de sidste fem årtier, og adskillige forfattere har fremsat deres egen vinkel på fænomenet med forskellige fortolkninger og forklaringer: Nogle har skrevet om blodets pH-værdi, andre om bindevævets pH-værdi – og næsten alle har skrevet om, hvordan kosten kan opdeles i syredannende og basedannende madvarer.
At kosten har en betydning for, hvordan kroppen anvender sine fysiologiske ressourcer for at opretholde den nødvendige surhedsgrad, der sikrer kropsvævenes fysiologiske funktion, er indiskutabelt. Bevis for dette ses i, hvordan forskellige madvarer påvirker urinens surhedsgrad, et fænomen, som er et tegn på en velfungerende reguleringsmekanisme. Men om der findes videnskabelige bilag for, at der er særlige sundhedsfordele at hente ved at opdele madvarerne i syre- eller basedannende, er diskutabelt, og mange tekster om emnet kan fra et videnskabeligt synspunkt virke modsigende. Det er tvivlsomt, at kosten alene er i stand til at genoprette fundamentale forstyrrelser i syre-basebalancen.
En kost, der fokuserer på såkaldt basedannende madvarer, vil i de fleste tilfælde bidrage med en positiv indflydelse på sundheden, da de fleste madvarer, der omtales som basedannende, kan betragtes som sunde. Men om sundhedsbidraget kan forklares på basis af madens basedannende egenskaber, næringsstofindhold eller et særligt indholdsstof vil altid være åbent til diskussion. Det blev fx i en undersøgelse om basedannende kost konkluderet, at en kostplan baseret på hypotesen om kostens indflydelse på syre-basebalancen faktisk havde en sundhedsfremmende virkning i kraft af en forbedring af både kroppens natrium-/kaliumbalance og cellernes enzymfunktion.
Urinsyre – en overraskende og dyster fortælling
Et af de syrlige stoffer, som ofte omtales i forhold til syrebelastning og sundhed, er urinsyre, hvor fortællingen om podagra og portvin har været en tilbagevendende favorit blandt undervisere i sygdomslære. Nyere forskning har genbesøgt urinsyre i forhold til, hvordan den påvirker vores fysiologi, og den nye indhentede viden skaber en overraskende og dyster fortælling om urinsyres rolle i udvikling af mange moderne livsstilssygdomme. De mekanismer, der knytter urinsyre til sygdomsudvikling, samt de tiltag, der skal til for at modvirke dem, forener to populære behandlingstilgange: syre-basebalance og antiinflammatorisk kost.
Her er et overblik over de næste mange sider
Den følgende artikel er et forsøg på at se på forskellige aspekter af syre-basebalancen, dens indflydelse på vores kropsvæv, og hvordan der kan opstå potentielle skadelige virkninger, når reguleringsmekanismerne bliver overbebyrdet. Historien om urinsyres centrale rolle i udvikling af livsstilssygdomme undersøges, hvor den forbindes med forstyrrelse i syre-basebalancen, inflammationsudvikling og metabolisk dysregulering. Artiklen er opdelt i følgende emner:
- Kroppens surhedsgrad
- pH buffer- og reguleringsmekanismer
- Syre-basebalancen i forhold til kroppens energikilder
- Syre-basebalancen i forhold til bindevæv og sygdomsudvikling
- Indflydelsen af urinsyre på vores fysiologi
Kroppens surhedsgrad
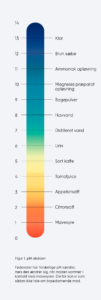
Surhedsgrad – pH-værdiSurhedsgrad er en kemisk enhed, der anvendes inden for fysiologien. Måleenheden for surhed er pH, hvor p står for potential og H for hydrogen (brint). Konceptet pH blev først introduceret af den danske kemiker Søren Peder Lauritz Sørensen (1868 – 1939), som var chef på Carlsberg-laboratoriet.pH-værdien angiver koncentrationen af brint-ioner i en opløsning. En brint-ion er et hydrogen-atom med en positiv ladning (H+). Den egentlige definition på måleenheden pH er meget indviklet, men det er et tal mellem 1 og 14, hvor pH 7,0 betragtes som neutral og svarer til antallet af brint-ioner i rent vand, og hvor alt over syv er basisk, og alt under syv er surt. På den mest basiske del af skalaen kan der nævnes fx klor med en pH på ca. 13,0, og i den anden ende af skalaen mavesyre med en pH på mellem 1,0 og 3,0 (se figur 1) Måling af pH kan foretages med et elektronisk pH-måleinstrument eller ved hjælp af UI (Universal Indikator) papir, som skifter farve efter pH-værdien. Skalaen, der bruges til beregning af opløsningers pH-værdier, er en såkaldt logaritmisk skala. pH-værdien angiver den negative logaritme til koncentrationen af brint-ioner i en opløsning.pH værdien af en opløsning beregnes ud fra koncentrationen af brint-ioner efter følgende formel:pH = -log (H+-koncentrationen)hvor koncentrationen angives i mol/l (eller molær). Rent vand med pH på 7,0 er neutralt og har derfor en koncentration af brint-ioner på 10-7 mol/L, eller 0,0000001 mol/L. Klor har med en pH på 13,0 en koncentration af brint-ioner på 10-13 mol/L, eller 0,0000000000001 mol/L (den negative logaritme angiver antallet af decimaler).Det er også vigtigt at forstå, at når måleenheden er angivet logaritmisk, betyder det, at en opløsning med en pH på 4,0 indeholder 10 gange flere brint-ioner end en opløsning med en pH på 5,0. Ligeledes har en opløsning med en pH på 3,0 10 gange flere brint-ioner end en opløsning med en pH på 4,0. |
Der har været en del diskussion om, hvordan syre-basebalancen skal forstås i forhold til kroppens fysiologi. Et godt udgangspunkt er forståelsen af begreberne syre og base, så lad os begynde med det. Måleenheden for surhedsgrad er pH, som står for potential hydrogen (hydrogen er den kemiske betegnelse for brint), der angiver antallet af frie, positivt ladede brintatomer i en opløsning. Et surt stof er således et stof, der frigiver brint-ioner, når det kommer i en opløsning (se informationsboksen).
Kroppens pH-værdi er forskellig, afhængigt af hvor den bliver målet, og pH-niveauet i kroppens forskellige organer og væv er nøje reguleret for at kunne opretholde en normal funktion. I forhold til syre-basebalancen er der blevet skrevet og talt en del om blodets pH-værdi, men ud fra en sundhedsvidenskabelig betragtning er blodets pH-værdi reguleret inden for meget snævre grænser, hvor selv små afvigelser kan have katastrofale konsekvenser. Blodet er let basisk med en normal pH-værdi på 7,4 og normale grænser på plus og minus 0,05. Målinger uden for disse grænser kan være livstruende, og en acidose med en blod-pH på under 6,8 anses for at være uforenelig med livet i klinisk forstand.
pH buffer- og reguleringsmekanismer
I den levende krop er der mange faktorer, som hvert øjeblik resulterer i frigørelse af frie brint-ioner. Et eksempel er kroppens metaboliske aktivitet, der er grundlaget for bl.a. muskelkontraktion, nervesignaltransmission og cellerespiration. Heldigvis har kroppen nogle såkaldte buffer- og reguleringsmekanismer, der er i stand til at binde frie brint-ioner, når blodets pH falder (bliver mere syrligt) og frigive dem, når blodets pH stiger (bliver mere basisk). Derved kan blodets pH-værdi holdes inden for de førnævnte kritiske grænser.
I den følgende tekst præsenteres en oversigt over kroppens vigtige buffer- og reguleringsmekanismer.
Bikarbonat-/kulsyrebuffermekanismen
Blodet indeholder stoffet bikarbonat (HCO3–), et negative ladet stof, der er dannet fra kulsyre (H2CO3), som selv er dannet fra kuldioxid (CO2) og vand (H2O). Formlen herunder viser den kemiske reaktion, hvorved der dannes bikarbonat. Det kan ses fra formlen, at dannelse af bikarbonat fra kulsyre sker ved frigørelse af en fri brint-ion (H+).
CO2 + H2O ⇌ H2CO3 ⇌ HCO3– + H+
kuldioxid + vand ⇌ kulsyre ⇌ bikarbonat + brint-ion
Nu tænker I måske: Hvordan kan en reaktion, der danner frie brint-ioner og derved skaber et potentielt syrligt miljø, fungere som en reguleringsmekanisme, der kan fjerne frie brintatomer fra blodet? Svaret ligger i det faktum, at reaktionen er en såkaldt bufferreaktion og kan køres baglæns (som vist med de tovejsrettede pile i ovenstående formel). Ved at se på reaktionen fra højre mod venstre kan frie brint-ioner (H+) bindes til bikarbonat (HCO3–) og danne kulsyre, som efterfølgende kan nedbrydes til kuldioxid og vand.
I kroppen fjernes kuldioxid fra blodet ved udånding, og derved er den frie brint-ion blevet bundet i et vandmolekyle og kan ikke bidrage til at skabe et syrligt miljø i blodet. Under normale kropslige tilstande er det ubevidste ændringer i både åndedrættets dybde og hastighed, som finregulerer blodets pH-værdi i forhold til normale dynamiske ændringer i produktionen af brint-ioner. Hvis kroppen har brug for at regulere blodets pH-værdi i den modsatte retning og øge antallet af frie brint-ioner, kan reaktionen køre i den modsatte retning (fra venstre mod højre).
Røde blodlegemer og hæmoglobin som buffer
En stigende koncentration af kuldioxid vil have en tendens til at gøre blodet mere syrligt ved at skubbe den førnævnte bufferreaktion fra venstre mod højere, kuldioxid spiller derfor en væsentlig rolle i forhold til blodets syre-basebalance, og der er flere buffermekanismer, hvor kuldioxid indgår. En af dem involverer de røde blodlegemer og hæmoglobin.
Ved stigende koncentration i blodet diffunderer kuldioxid over de røde blodlegemers cellemembraner ind i cellerne, hvor der kan forekomme to scenarier:
- Inde i de røde blodlegemer forbindes kuldioxid med vand i en reaktion magen til bikarbonat-/kulsyremekanismen beskrevet ovenfor, hvor der dannes kulsyre (H2CO3). Derefter dissocierer (adskilles) de kulsyremolekylerne, hvorved der skabes bikarbonat (HCO3–) og brint-ioner (H+). Brint-ionerne bliver bundet til hæmoglobin og er derved forhindret i at have en yderligere indflydelse på blodets pH-værdi – dannelsen af kulsyre drives af et katalyserende enzym, som hedder kulsyreanhydrase, hvis koncentration stiger ved en faldende pH-værdi i blodet.
- Inde i de røde blodlegemer kan kuldioxid bindes til hæmoglobin med den konsekvens, at kuldioxid bliver fjernet fra blodet og derved er forhindret i at skubbe bufferreaktionen hen mod højre, hvor der ellers vil blive dannet flere brint-ioner, der vil gøre blodet mere syrligt.
Nyrernes rolle i syre-basereguleringen
De førnævnte buffermekanismer har til opgave at finregulere potentielle stigninger og fald i blodets pH-værdi i forhold til umiddelbare minut-for-minut dynamiske ændringer. Det er dog nyrerne, som skaber en grundtilstand i blodet, der danner et baggrundsmiljø, over hvilket buffermekanismer kan bistå med finregulering.
I forhold til denne opgave har nyrerne to hovedfunktioner:
- Genoptagelse af bikarbonat
- Dannelse af bikarbonat
Disse to hovedfunktioner involverer mange komplekse trin, og den følgende tekst er et forsøg på at give et overblik over hovedelementerne i processerne.
Genoptagelsen af bikarbonat
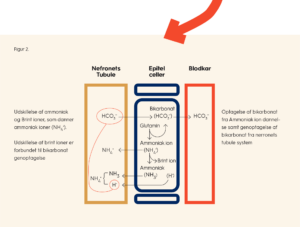
I nyrerne filtreres bikarbonat fra blodet ind i den såkaldte præurin i nefronerne. På vejen igennem nefronerne bliver 85 pct. af bikarbonatet i præurinen genoptaget, som sker primært i den første del af nefronerne – den proksimale tubulus. En stor del af det resterende bikarbonat bliver genoptaget længere henne i nefronet – ved det ascenderende tykke ben af Henles slynge. Genoptagelsen af bikarbonat, som er et led i nyrernes syre-basereguleringsmekanisme, reguleres i forhold til blodets pH-værdi, hvor stoffet angiotensin II spiller en væsentlig rolle.
Bikarbonatgenoptagelse er forbundet med en udskillelse af brint-ioner, der bliver skabt ved ammoniakdannelse, som forklares i det næste afsnit (se også figur 1).
Dannelse af bikarbonat
Bikarbonatdannelse omfatter to andre led i nyrernes syre-basereguleringsmekanismer, nemlig ammoniakdannelse og udskillelse af brint-ioner.
Ammoniakdannelse foregår i alle epitelceller (dækvævsceller) i nyrernes tubulussystem, men i særdeleshed i cellerne, der findes i den proksimale tubulus. Produktionen af ammoniak opreguleres i forhold til både en faldende pH i blodet (øget syrlighed) samt en faldende pH-værdi i urinen.
Udgangspunktet for ammoniakdannelsen er aminosyren glutamin:
C5H10N2O3
Glutamin
Glutamin metaboliseres via en række kemiske processer til bl.a. ammoniak (NH3) og bikarbonat (HCO3–). Det nydannede bikarbonat bliver transporteret ind i blodbanen (se Figur 1), hvor det indgår i bikarbonat-/kulsyre-buffermekanismen, som er omtalt tidligere i teksten.
Det nydannede ammoniakmolekyle kan eksistere i to former: Som ammoniak (NH3) eller som en ammoniak-ion (NH4+). Koncentrationsforholdet mellem de to ammoniakformer er, ligesom mange andre kemiske reaktioner, der regulerer syre-basebalancen, afhængigt af en bufferreaktion:
NH3 + H+ ⇌ NH4+
Ammoniak + brint-ion ⇌ Ammoniak-ion
Ammonisk dannelse og bufferreaktionen skaber en dynamisk fleksibilitet, der bidrager til regulering af kroppens syre-basebalance:
Ammoniak-ionen (NH4+) kan udskilles fra epitelceller i præurinen og den ekstra brint-ion, der var bundet til ammoniak, bliver hermed også udskilt, hvor den gør urinen mere syrlig (som nævnt tidligere er denne udskillelsesmekanisme forbundet med optagelse af bikarbonat fra nyrernes tubulussystem, som er illustreret i figur 2.)
Set fra et syre-basereguleringssynspunkt vil den faldende pH-værdi i blodet (øget syrlighed) forårsage:
- Øget optagelse af bikarbonat
- Øget ammoniakproduktion
- Øget udskillelse af brint-ioner
En stigende pH-værdi i blodet (øget basetilstand) vil forårsage:
- Nedsættelse af udskillelsen af brint-ioner
- Nedsættelse af bikarbonatoptagelse – og dermed nedsætte udskillelse af brint-ioner
Nyrernes bidrag til syre-baseregulering har en stor betydning for kroppens indre syre-basemiljø. Samtidig står nyrerne – i deres rolle som udskillelsesorgan – i frontlinjen, når det drejer sig om ophobede metaboliske syrestoffer. Heldigvis er nyrernes udskillelseskapacitet tilstrækkelig til at kunne regulere de metaboliske syrestoffer, som skabes ved en normal, sund levevis, men overskrides denne kapacitet, kan nyrerne lide overlast, og der kan opstå kroniske nyresygdomme, hvor nyrernes syre-basereguleringskapacitet nedsættes, og der igangsættes en negativ spiral, som i ekstreme tilfælde kan ende med nyresvigt.
Knoglernes rolle i syre-basebalancen
Knoglernes rolle i syre-basereguleringen blev første gang omtalt i 1968, hvor belastning af syre-basebalancen bliver forbundet til udviklingen af osteoporose. I dag findes der en del forskning, som understøtter den forbindelse og inddrager samtidig knoglernes fysiologi som en vigtig del af syre-basebalancens reguleringsmekanismer.
Knoglestruktur består primært af calcium, fosfor og kollagen i en matrix, der også indeholder en stor del bundet kuldioxid (CO2) i form af karbonat (CO32-) og bikarbonat (H2CO3–), hvilket gør, at knoglerne kan medvirke som buffer i reguleringen af syre-basebalancen.
Knoglernes buffermekanisme består af to processer:
- Optagelse af brint-ioner (H+)
- Frigørelse af karbonat (CO32-) og bikarbonat (H2CO3–)
Optagelsen af brint-ioner sker ved ombytning af calcium-ioner (Ca2+) i knoglestrukturen til brint-ioner (H+). Derved bliver brint-ionerne taget ud af kredsløbet med den konsekvens, at blodets pH-værdi stiger. Denne ombytning sker uden umiddelbar nedbrydning af knoglerne. I kontrast er frigørelsen af karbonat og bikarbonat nemlig forbundet med nedbrydning af knoglestrukturen. Ved et fald i pH-værdien i blodet aktiveres osteoklasterne – de knogleceller, der nedbryder knoglesubstansen – hvorved der frigives calcium-ioner (Ca2+), karbonat og bikarbonat.
Det er frigivelsen af bikarbonat, der bidrager til syre-basereguleringen, da det indgår i bikarbonat-/kulsyre-buffermekanismen, som er omtalt tidligere i teksten.
Syre-basebalancen i forhold til kroppens energikilder
Det er energi fra kosten, der driver kroppens fysiologiske processer, som er selve grundlaget for livet. Fra et ernæringsperspektiv får kroppen sin energitilførsel fra indtagelse og nedbrydning af kulhydrater, fedt og protein.
Overordnet set kræver kulhydrat- og fedtmetabolismen tilførsel af ilt, og ved frigørelse af energien skabes der kuldioxid og vand. Ud fra den antagelse står det klart, at der er tale om processer, der er syreskabende, da kuldioxid og vand vil skubbe buffermekanismen i retning af brint-ion-dannelse (fra venstre mod højre). Hos en sund og rask person vil buffermekanismernes kapacitet normalt ikke overstiges, og kroppen vil kunne akkommodere evt. brint-ion-dannelse.
CO2 + H2O ⇌ H2CO3 ⇌ HCO3– + H+
kuldioxid + vand ⇌ kulsyre ⇌ bikarbonat + brint-ion
Proteinmetabolisme har også en netto syreskabende indflydelse, hvor der dannes bl.a. saltsyre (HCl) og svovlsyre (H2SO4). Disse syrestoffer bliver hurtigt taget imod af endnu en buffermekanisme, der involverer anvendelse af natrium (Na), hvorved der skabes natriumsalte (hhv. natriumklorid og natriumsulfat), kuldioxid og vand (se nedenfor).
HCl + NaHCO3 → NaCl + CO2 + H2OH
saltsyre + natriumhydrogenkarbonat → natriumklorid + kuldioxid + vand
H2SO4 + 2NaHCO3 → Na2SO4 + 2CO2 + 2H2O
svovlsyre + 2 natriumhydrogenkarbonat → natriumsulfat + 2 kuldioxid + 2 vand
Nyrerne udskiller natriumsaltene, og kuldioxid og vand vil normalt håndteres af bikarbonat-/kulsyrebuffermekanismen eller udskilles via lungerne.
Ud fra dette kan man begynde at forstå, hvordan kosten har en indflydelse på buffermekanismernes og nyrernes håndteringskapacitet. Hos en sund og rask person med en fornuftig kost ser man normalt ikke umiddelbart konsekvenser af buffersystembelastning. Men i de tilfælde, hvor buffermekanismernes kapacitet overstiges, kan der opstå en metabolisk acidose-tilstand, der kan give anledning til, at kroppen begynder uhensigtsmæssigt at anvende andre løsninger til at kompensere for en overskydende syrlig tilstand, og det er her, at den klassiske fortælling om syre-basebalancen ofte begynder.
Nyere forskning viser dog, at selv om kroppens buffersystem arbejder inden for dets normale kapacitet, kan en tilstand, der udfordrer buffersystemerne over længere tid, forårsage kroniske inflammatoriske forandringer i knogle- og bindevævet. Dette scenarie – med et langvarigt overbebyrdet buffersystem – skaber en såkaldt latent acidose-tilstand, der typisk ses med stigende alder på grund af nedsat nyreaktivitet og et relativt højt protein- og sukkerindtag.
Syre-basebalancen i forhold til bindevæv og sygdomsudvikling
At metaboliske acidose-tilstande kan have en indflydelse på bindevævet, er en kendsgerning, som har haft plads i lærebøgerne i mange årtier, men her er der normalt kun tale om de såkaldt krystal-inducerede gigttilstande, som hovedsagelig omfatter podagra, pseudopodagra samt kalcificerende (forkalkende) tendinitis. Alle disse tilstande er karakteriseret ved deponering af saltkrystaller i bindevævet, der forårsager inflammation og kan forbindes med ændringer i metabolismen af syrestoffer.
- Podagra er karakteriseret ved deponering af mononatriumurat-krystaller i bl.a. ledbrusk, ledbånd og sener
- Pseudopodagra er karakteriseret ved deponering af calciumpyrofosfat i ledbrusk og meniskstrukturer
- Kalcificerende tendinitis er karakteriseret ved kalcificering af sener med calciumapatit (også kaldt hydroxyapatit)
Der findes dog et mere omfattende og skjult forhold mellem kroniske inflammationstilstande og syre-basebalancen i forhold til kroppens bindevævsstrukturer.
Bindevæv findes ikke kun i forbindelse med bevægeapparatstrukturer, men udgør en integreret del af alle kroppens væv, hvor det har en regulerende indflydelse på vævscellernes organisering og metabolisme. Med andre ord er kropsvævene afhængige af et velfungerende bindevævsnetværk.
På det mikroskopiske plan består bindevævet af et netværk af forskellige proteinfibre, hvis sammensætning giver de forskellige bindevævstyper deres særlige karakteristika. Disse proteinfibre danner både en form for stillads, der skaber et fundament for vævsstrukturen, samt en ekstracellulær matrix for vævscellerne, der hovedsagelig består af vand og nogle polysakkarid-/aminosyrestrukturer, kaldet proteoglykaner, som er forbundet til bindevævets proteinfibre.
Proteoglykaner – ny forskning med vigtige budskaber
Nyere forskning har undersøgt proteoglykanernes indflydelse på vævscellerne, og de overraskende resultater har drevet studiet af proteoglykaner helt frem i moderne biomedicinsk forskning. Proteoglykaner er opbygget af uforgrenede, sammenkædede polysakkarider, aminosukker og stoffet uronsyre, som indgår i de samlede kemiske strukturer, der indeholder mange negativt ladede kemiske grupper. Dette betyder, at proteoglykanstrukturen tiltrækker positivt ladede ioner såsom natrium (Na+), der tiltrækker vand – hvilket resulterer i, at vand bliver indlemmet i den ekstracellulære matrix, hvor den bl.a. bidrager til at skabe bindevævets mekaniske egenskaber.
Tilstedeværelsen af de mange ladede kemiske grupper i proteoglykanernes molekylære opbygning betyder, at de er meget følsomme over for pH-ændringer. En latent acidose-tilstand kan dermed forstyrre proteoglykanernes evne til at binde vand, hvilket kan have en umiddelbar indflydelse på bindevævets mekaniske egenskaber og evt. hæmme bindevævets normale funktion. I tilfælde, hvor det pågældende bindevæv spiller en afgørende mekanisk funktionel rolle – fx i ledbrusk og andre bindevævsledstrukturer – kan konsekvensen af en ændring i bindevævets mekaniske egenskaber resultere i funktionssvigt og inflammationsudvikling. Processen derfra vil være selvforstærkende, da inflammation forårsager en ændring i pH-værdien omkring vævet mod en mere syrlig tilstand, som stimulerer produktion af interleukin-1β, som er et kraftfuldt proinflammatorisk cytokin.
Ud over at bidrage til vævets mekaniske egenskaber fungerer den ekstracellulære matrix som en biokemisk transitvej for vævscellernes forsyning med vand, næringsstoffer, ilt, kuldioxid og elektrolytter og bidrager til regulering og bortskaffelse af metaboliske produkter. Desuden agerer den ekstracellulære matrix som et reservoir for bioaktive stoffer som cytokiner, kemokiner og vækstfaktorer og spiller samtidig en væsentlig rolle som et biokemisk og biomekanisk signaleringsmedie. Samspillet mellem vævscellerne og proteoglykanerne kan udløse forskellige cellulære reaktioner, der er afgørende for bl.a. vævscellernes homøostase, differentiering og styring af programmeret celledød (apoptose).
Ud fra ovenstående kan det antages, at opretholdelse af en sund, funktionel vævsstruktur er forbundet med både proteoglykanernes indflydelse på vævscellernes regulerings- og styringsfunktioner og en nøje regulering af de biokemiske forhold i den ekstracellulære matrix. Det er i denne sammenhæng, at en latent acidosetilstand kan forårsage forstyrrelser i proteoglykan-aktiviteten og derved i vævet og give anledning til inflammation.
Forstyrrelse i proteoglykan-aktiviteten ses ved mange livsstilsygdomme, hvor det menes, at kostvaner kan have en signifikant betydning. Flere studier har vist, at forstyrrelse i proteoglykan-aktiviteten er relateret til:
- Udvikling af diabetes II
- Udvikling af kræft
- Fedme
- Gigtsygdomme
- Hjerte-kar-sygdomme
Forskning på proteoglykaner og deres interaktion med cytokiner og kemokiner samt deres indflydelse på cellemetabolismen giver dem en central rolle i forhold til regulering af inflammationsreaktioner. Som vi har set, er proteoglykanernes tilpassede funktion afhængig af deres molekylære struktur, som er følsom over for vævets syre-basemiljø. Det er her, der kan drages en forbindelse mellem en latent acidose, forstyrrelse i proteoglykanernes regulerende funktion og en proinflammatorisk tilstand i kropsvævet, som kan danne grundlag for mange af de livsstilssygdomme, der er omtalt i foregående afsnit.
Urinsyre og dens betydning
Urinsyre er en af de kilder til cirkulerende brint-ioner, som trækker vævets syre-basemiljø mod en mere syrlig tilstand. Stoffet dannes bl.a. ved nedbrydning af to af de purinstofbaser, adenin og guanin, som findes i nukleinsyrerne DNA og RNA. Både kost, indtagelse af mad med et højt cellulært indhold, fx kød og skaldyr, og naturlig nedbrydning af egne kropsceller er dermed kilder til urinsyredannelse. Urinsyre dannes også ved motion og øget muskelaktivitet, hvor dannelsen af stoffet adenosin-mono-fosfat (AMP) og opståede celleskader danner grundlag for urinsyreproduktion. Motion kan i øvrigt resultere i kortvarigt høje urinsyrekoncentrationer i blodet, da motion midlertidigt nedsætter nyrernes udskillelse af stoffet.
I forhold til den traditionelle fortælling om syre-basebalancen er urinsyre mest omtalt i forbindelse med nyrestensdannelse og urinsyregigt (podagra). Nyere forskning er dog begyndt at belyse, at urinsyre spiller en central rolle i reguleringen af kroppens metabolisme, og at denne rolle har negative konsekvenser i en moderne livsstils kontekst. Urinsyres indflydelse på det moderne menneskes metabolisme kan skabe et potentielt farligt fysiologisk samspil, der viser sig at være en væsentlig faktor i forhold til udvikling af de såkaldte moderne kroniske livsstilssygdomme, der omfatter bl.a.:
- Hypertension (højt blodtryk)
- Diabetes II
- Metabolisk syndrom
- Kroniske nyresygdomme
Det, der er interessant i den sammenhæng, er, at mennesket er et af de få pattedyr, som ikke er i stand til at nedbryde urinsyre, og det giver anledning til at overveje, hvorfor vores fysiologi er anderledes end de fleste af vores artsfællers.
Historien om menneskets særlige forhold til urinsyre begynder i den såkaldte miocæntid (for ca. 23,5 mio. år siden), hvor der skete en række mutationer i en gensekvens, som koder for enzymet uricase. Mutationerne kulminerede i et tab af enzymets funktion for ca. 15 mio. år siden hos vores forfædre. Uricase er et leverenzym, der er involveret i nedbrydningen af urinsyre, og som produceres hos de fleste pattedyr, der findes på kloden i dag – dog på grund af de førnævnte mutationer ikke hos de store menneskeaber (chimpanser, gorillaer og orangutanger) og mennesker. For at kunne forstå, hvorfor disse genmutationer, der i dag kan give anledning til sygdomsudvikling, ikke har resulteret i udryddelse af menneskeaberne gennem flere millioner års evolution, er det nødvendig at se på urinsyrens centrale betydning for fysiologien og forstå, hvordan den har tilført vores forfædre en evolutionær fordel og derfor stadig findes hos de nulevende efterkommere, de store menneskeaber og mennesker, hvor den nu udgør en trussel mod vores sundhed.
Som tidligere nævnt dannes urinsyre fra nedbrydning af purinstoffer fra kosten, fra egne døde celler og fra nedbrydning af stoffet AMP. Da mennesket mangler enzymet uricase, er gennemsnitskoncentrationen i blodet op til 10 gange højere end hos andre pattedyr. I nyrerne filtreres urinsyre til udskillelse, men op mod 90 pct. af den filtrerede mængde genabsorberes i nyrernes tubulussystem og bidrager til en relativt høj koncentration af stoffet i blodet sammenlignet med andre pattedyr. Normalværdien hos mennesket betragtes som værende mellem 4,1 og 8,6 mg/dl for mænd og mellem 2,9 og 7,2 for kvinder, men disse værdier anses ikke for at være optimale i henhold til nyere forskning på området hvor der forslås et maksimum på 5,0 for mænd og en værdi mellem 2,0 og 4,0 for kvinder.
Urinsyre påvirker både positivt og negativt!
Urinsyre påvirker kroppen på flere måder, og i forhold til moderne menneskers sundhed er påvirkningen tvetydig, da den har både positiv og negativ indflydelse på nogle af kroppens fundamentale fysiologiske processer:
- Har antioxiderende aktivitet (uden for kropscellerne)
- Har oxiderende aktivitet (inde i cellerne)
- Har proinflammatorisk aktivitet
- Indgår i reguleringen af kroppens immunaktivitet
- Igangsætter ændringer i reguleringen af kroppens metabolisme
- Forårsager insulinresistens
- Forårsager en stigning i blodtrykket
Nøglen til en forståelse af konsekvenserne ved urinsyrens tvetydige egenskaber er adgangen til kalorierig mad i en evolutionær kontekst. Det er urinsyrens indflydelse på metabolismen og blodtrykket, der havde og stadig har en særlig betydning i forhold til menneskeracens udvikling og sundhed.
Urinsyres indflydelse på metabolismen
Menneskets fundamentale fysiologi har ikke ændret sig i ca. 10.000 år (Templeton 2010), hvilket betyder, at det moderne menneskes fysiologiske processer er tilpasset en tilværelse som nomadiske jæger/samlere i den sene stenalder. Problemerne opstår, når vores livsvilkår i dag ikke stemmer overens med de livsvilkår, som har dannet grundlaget for udviklingen af vores fysiologi.
Da vores forfædre tilbage i miocæntiden mistede evnen til at producere det urinsyrenedbrydende enzym uricase, skete det på et tidspunkt, hvor der var en global nedkøling, og for vores forfædre i Europa gav tabet af uricase en evolutionær fordel i det geografiske område, hvor nedkølingen begrænsede adgangen til kalorierig mad. Dette skyldes, at urinsyre fungerer som en trigger for en række fysiologiske overlevelsesmekanismer, der sikrer vores fortsatte eksistens, når adgang til kalorierig mad er begrænset.
For mange pattedyrarter er fruktose en kaloriekilde, der er nødvendig for deres overlevelse, fordi fruktose hurtigt og effektivt metaboliseres i leveren, primært for at opbygge leverens glykogenreserver og danne fedt. Forskning har vist, at blodets urinsyrekoncentration stiger ved fruktoseindtag, da urinsyre dannes i forhold til fruktosemetabolismen. Som konsekvens af blodets stigende koncentration af urinsyre pga. fruktoseindtag ændres kroppens metabolisme hen mod en overlevelsesstrategi, i og med at det igangsætter en række fysiologiske ændringer:
- Effektivisering af fedtdannelse fra indtagelse af fruktose → sikrer dannelse af energireserver
- Stimulering af appetitten ved at skifte balancen mellem sult- og mæthedshormonerne ghrelin og leptin → øger mæthedspunktet og hæmmer den naturlige begrænsning af kalorieindtag
- Udvikling af insulinresistens → nedsætter cellernes energimetabolisme og virker derved energibesparende
- Øgning af blodtrykket (som følge af at natriumudskillelsen og nitrogenoxids indflydelse på
blodkarrene hæmmes) → kompenserer for evt. væsketab forbundet med vandmangel/tørke
Evolutionsmæssigt er konsekvensen af samspillet mellem de første to punkter en øgning af kroppens fedtdepoter, hvilket er fordelagtigt, når adgangen til næringsrig mad er periodevist begrænset – fx når der skal opbygges et energilager for at kunne overleve vinteren, mens sensommerens og efterårets frugter er tilgængelige. For det moderne menneske, hvor adgangen til næringsrig mad for de fleste er ubegrænset, skaber samspillet mellem de første to punkter i listen ovenfor en dysregulering af kroppens metabolisme med overspisning og øget fedtvævsdannelse. Kombinationen af øget fedtvævsdannelse og det tredje punkt på listen, udvikling af insulinresistens, danner grundlaget for udvikling af metabolisk syndrom.
Tilbageholdelse af natrium, som er det sidste punkt på listen, vil resultere i en øgning af blodtrykket, hvilket giver en evolutionsmæssig fordel, når kosten hovedsagelig består af natriumfattige elementer i form af frugt og blade, og hvor der periodevis er begrænset adgang til vand. Men for det moderne menneske er højt blodtryk en uvelkommen tilstand med en dyster prognose – især i tilfælde, hvor de første tre punkter på listen har haft indflydelse og har skabt et fysiologisk scenarie præget af metabolisk dysregulering.
Forskere har dog påpeget, at det moderne menneskes eksponering for fruktose fra frugt ikke har den store betydning i forhold til urinsyredannelse og sygdomsudvikling, hvis indtaget af frugt ikke er overdrevet (under ca. 300 gram dagligt). Til gengæld er vores indtag af produkter, der indeholder almindelig sukker og andre kilder til høje koncentrationer af fruktose, meget bekymrende. I den anledning burde det nævnes, at i 2017 ophævede de europæiske fødevaremyndigheder et forbud mod anvendelsen af høj fruktose majssirup (high fructose corn syrup – HFCS) i madvarer, selvom forskere ser det som en alvorlig trussel mod vores sundhed i denne sammenhæng.
Konklusion
I forhold til moderne forskning står det klart, at dysregulering af syre-basebalancen kan have alvorlige sundhedsmæssige konsekvenser, og at kosten spiller en afgørende rolle i kroppens syre-basereguleringsmekanismer. Dette er en påstand, som har været gentaget af mange behandlere gennem flere årtier, og nu – takket være nyere forskning – står det meget klart, at regulering af kroppens syre-baseforhold har en stor betydning i forhold til kroniske inflammationstilstande, hjerte-kar-sygdomme og problemer relateret til dysregulering af metabolismen. Der er derfor stadig god grund til at anbefale et indtag af de madvarer, der betragtes som basedannende, men med den nye viden om urinsyres betydning bliver syre-basebalance-fortællingen mere nuanceret. I princippet burde fokus flyttes fra basedannende kost til antiinflammatorisk kost, selv om grænserne mellem de to tilgange til sund kost har et stort overlap.
Før i tiden blev måling af urinens pH en måde at kontrollere, hvordan kosten påvirker syre-basebufferen, men med den nye indsigt i urinsyres betydning kunne det overvejes, at blodets urinsyrekoncentration overvåges som en indikator for effektiviteten af en indsats til at aflaste kroppens fysiologi og mindske risikoen for sygdomsudvikling og bl.a. sænke de urinsyrekoncentrations værdier, man anser for normale i dag til et lavere niveau for at forebygge de mange livsstilssygdomme.
Atter viser videnskabelig forskning, at traditionel viden baseret på empiri har sin plads i en moderne kontekst, og at videnskab med tiden vil bekræfte og forsvare de mere abstrakte og esoteriske teorier anvendt af en række behandlere gennem tiderne, men vil også bidrage med ny viden, der skaber en mere nuanceret forståelse af sundhed og sygdomme og behandlingsindsatsen.





I don’t think the title of your article matches the content lol. Just kidding, mainly because I had some doubts after reading the article.